Cinética química é o tema da vez no Lá Vem o Enem. O professor Diogo, o Giga, explica como as reações químicas ocorrem e a velocidade delas, conteúdo essencial para se dar bem no exame.
Você sabia que a cinética química aparece em situações do dia a dia, como conservar alimentos ou tomar um remédio?
Responda a mais questões e simulados
Não esquece: assista à aula completa e chegue pronto para responder às questões.
Resolva questões de cinética química
Questão 1
Os combustíveis utilizados em veículos automotivos no Brasil são basicamente a gasolina e o etanol, cuja queima incompleta libera gases tóxicos para a atmosfera, como o monóxido de carbono (CO) e o monóxido de nitrogênio (NO). Uma vez que estes gases provenientes da queima incompleta são mais danosos ao meio ambiente do que os da combustão completa, os veículos são fabricados com dispositivos antipoluição instalados no cano de escape do automóvel, denominados catalisadores automotivos, que completam a conversão a gases menos poluentes, como o CO2 e N2.
O catalisador automotivo é constituído de um suporte na forma de colmeia, em geral de material cerâmico (às vezes metálico), revestido de óxido de alumínio. Sobre este revestimento é fixada a substância que de fato atua como um catalisador químico, geralmente uma liga de paládio e ródio para os motores a gasolina e uma liga de paládio e molibdênio para os motores a álcool.
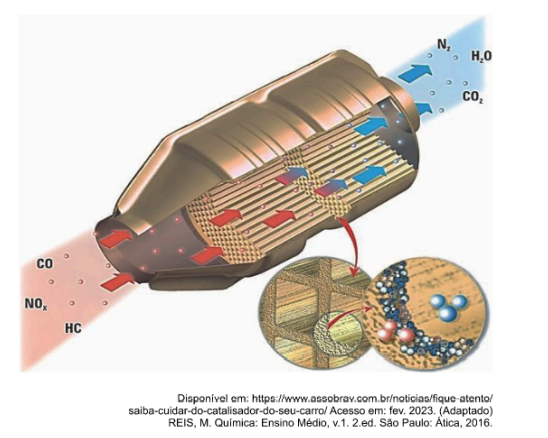
Assinale a alternativa correta que corresponde à função de um catalisador em reações químicas.
a) Um catalisador aumenta a velocidade e o rendimento de uma reação química, uma vez que diminui a energia de ativação da reação por meio da alteração do mecanismo reacional, fornecendo dessa forma um caminho alternativo.
b) Um catalisador aumenta o rendimento de uma reação química, uma vez que diminui a energia de ativação da reação por meio da alteração do mecanismo reacional, fornecendo dessa forma um caminho alternativo.
c) Um catalisador aumenta a velocidade de uma reação química, uma vez que aumenta a energia de ativação da reação por meio da alteração do mecanismo reacional, fornecendo dessa forma um caminho alternativo.
d) Um catalisador aumenta o rendimento de uma reação química, uma vez que altera a energia dos reagentes e produtos sem alterar a energia de ativação da reação e mecanismo reacional.
e) Um catalisador aumenta a velocidade de uma reação química, uma vez que diminui a energia de ativação da reação por meio da alteração do mecanismo reacional, fornecendo dessa forma um caminho alternativo.
Questão 2
O uso de catalisadores em processos químicos é usual e muito importante. Grandes investimentos são realizados tanto por empresas quanto por órgãos públicos visando a síntese de materiais que atuem como catalisadores cada vez mais seletivos e eficientes.
Dessa forma, busca-se atingir a inovação tecnológica de materiais e processos químicos.
Os catalisadores aumentam a velocidade da reação química, porque
a) permitem que reações não espontâneas se tornem espontâneas.
b) permitem que a reação se desenvolva por um caminho de reação exotérmico.
c) permitem que a reação se desenvolva por um caminho de menor energia de ativação.
d) promovem o aumento da energia cinética dos reagentes.
e) permitem que a reação se desenvolva por um caminho de reação em fase homogênea.
Questão 3
O cientista Richard Feynman, prêmio Nobel de Física em 1965, fez comentários sobre o processo de combustão em uma entrevista chamada Fun to Imagine. Segundo ele, à primeira vista, é impressionante pensar que os átomos de carbono de uma árvore não entram em combustão com o oxigênio da atmosfera de forma espontânea, já que existe uma grande afinidade entre essas espécies para a formação de CO2. Entretanto, quando a reação tem início, o fogo se espalha facilmente. Essa aparente contradição pode ser explicada pois
a) a reação depende de um processo que concentre o carbono para ocorrer.
b) o fogo torna a reação desfavorável.
c) o fogo depende da presença de CO2 para começar.
d) o átomo de carbono da árvore é muito mais resistente ao O2 do que os átomos de
carbono dispersos no fogo.
e) a reação precisa de uma energia de ativação para começar.
Questão 4
Um grupo de alunos construiu um biodigestor a partir de garrafas de polietileno tereftalato (PET) e galões de água para reaproveitar resíduos alimentares da escola.
No entanto, após uma semana, não observavam formação de biogás como era esperado. Para melhorar a eficiência do biodigestor, os alunos decidiram fazer uma adaptação no gerador de biogás. O biodigestor foi envolvido com saco plástico preto e exposto à radiação solar. Com essa configuração, após dois dias, foram observadas as primeiras bolhas.
Com base na adaptação feita pelos alunos, é correto afirmar que o fator cinético que contribuiu para aumentar a velocidade das reações que ocorreram no biodigestor foi a
a) luz.
b) umidade.
c) temperatura.
d) forma do recipiente.
e) área da superfície do gerador
Questão 5
Segundo a teoria das colisões efetivas, para que uma reação ocorra é necessário que as moléculas dos reagentes colidam umas com as outras com orientação espacial adequada e energia mínima. Assim, qualquer alteração no meio reacional que interfira nesses dois fatores modifica a velocidade da reação. A figura mostra o sistema reacional gasoso 1 submetido a modificações que proporcionaram os sistemas 2 e 3.
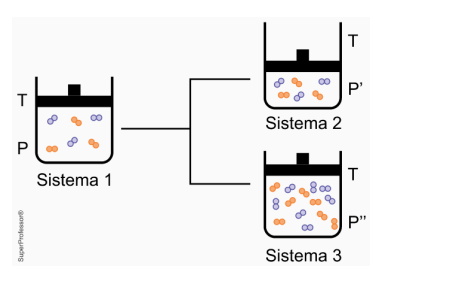
Considerando que as moléculas existentes nesses sistemas reajam entre si, as relações entre as velocidades (V) das reações dos sistemas 1 e 2 e dos sistemas 1 e 3 são, respectivamente,
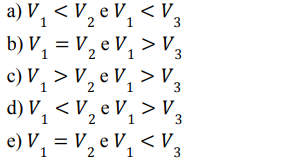
Questão 6
Em uma aula no laboratório de química, o professor propôs, a cinco grupos de alunos,
um experimento envolvendo a reação de zinco metálico (Zn) e solução aquosa de ácido
clorídrico (𝑙 ), que se processa de acordo com a equação:
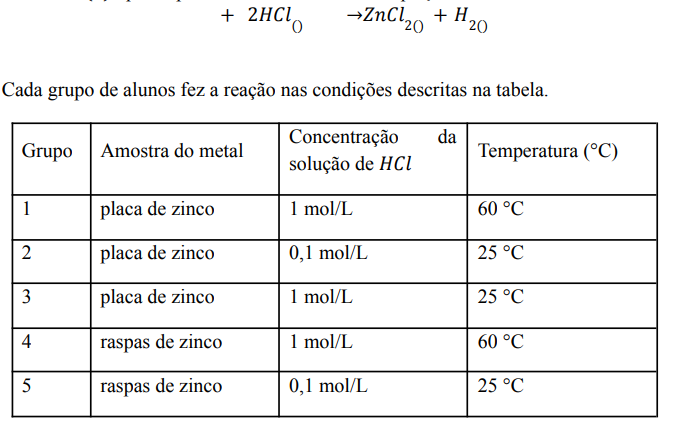
Considerando que todos os grupos usaram massas iguais de zinco e solução aquosa de ácido clorídrico em excesso, o experimento em que todo o zinco metálico foi consumido em menor intervalo de tempo foi o do grupo
a) 2.
b) 3.
c) 5.
d) 4.
e) 1.
Questão 7
A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que
ocorrem em condições de
a) alta pressão.
b) alta temperatura.
c) excesso de reagentes.
d) maior superfície de contato.
e) elevada energia de ativação.
Questão 8
A gasolina é um combustível constituído por uma mistura de diversos compostos químicos, principalmente hidrocarbonetos. Estes compostos apresentam volatilidade elevada e geram facilmente vapores inflamáveis.
Em um motor automotivo, a mistura de ar e vapores inflamáveis de gasolina é comprimida por um pistão dentro de um cilindro e posteriormente sofre ignição por uma centelha elétrica (faísca) produzida pela vela do motor.
Adaptado de: BROWN, Theodore; L. LEMAY, H Eugene; BURSTEN, Bruce E. Química a Ciência Central, 9ª edição, Editora Prentice-Hall, 2005, pág. 926.
Pode-se afirmar que a centelha elétrica produzida pela vela do veículo neste evento tem a função química de
a) catalisar a reação por meio da mudança na estrutura química dos produtos, saindo contudo recuperada intacta ao final do processo.
b) propiciar o contato entre os reagentes gasolina e oxigênio do ar (𝑂2), baixando a
temperatura do sistema para ocorrência de reação química.
c) fornecer a energia de ativação necessária para ocorrência da reação química de combustão.
d) manter estável a estrutura dos hidrocarbonetos presentes na gasolina.
e) permitir a abertura da válvula de admissão do pistão para entrada de ar no interior do motor.
Questão 9
“A Olimpíada deve ser disputada sem o fantasma da fraude química, dentro do princípio de que, tanto quanto é importante competir, vencer é prova de competência”.
Jornal O Globo, 28/05/2016.
Considere que um atleta tenha consumido 64 𝑚𝑔 de um anabolizante e que, após 4 dias, o exame antidoping tenha detectado apenas 0, 25 𝑚𝑔 deste composto. Assumindo que a degradação do anabolizante no organismo segue uma cinética de 1ª ordem, assinale a alternativa que apresenta o tempo de meia-vida da substância no organismo do atleta.
a) 4 horas
b) 6 horas
c) 8 horas
d) 12 horas
e) 48 horas
Questão 10
O sulfeto de mercúrio (II) foi usado como pigmento vermelho para pinturas de quadros e murais. Esse pigmento, conhecido como vermilion, escurece com o passar dos anos, fenômeno cuja origem é alvo de pesquisas. Aventou-se a hipótese de que o vermilion seja decomposto
sob a ação da luz, produzindo uma fina camada de mercúrio metálico na superfície. Essa reação seria catalisada por íon cloreto presente na umidade do ar.
WOGAN, T. Mercury’s Dark Influence on Art. Disponível em: www.chemistryworld.com. Acesso
em: 26 abr. 2018 (adaptado).
Segundo a hipótese proposta, o íon cloreto atua na decomposição fotoquímica do vermilion
a) reagindo como agente oxidante.
b) deslocando o equilíbrio químico.
c) diminuindo a energia de ativação.
d) precipitando cloreto de mercúrio.
e) absorvendo a energia da luz visível.
GABARITO
- E
- C
- E
- C
- A
- D
- D
- C
- D
- C


